一、 前言
自來水經水廠淨化處理後,為避免輸送過程於管線中細菌孳生而影響用水安全,通常會在最後階段添加氯進行消毒。正常狀態下,氯通常以氯分子(Cl2)形態存在(氣態),其具高反應性且易與其他元素結合,故地殼中大部分以氯化合物之形式存在,例如生活中常接觸之食鹽(NaCl);氯與水反應則會生成產生「次氯酸」(HOCl),而次氯酸會進一步解離成次氯酸根離子(OCl-),HOCl及OCl- 統稱為自由氯(Free available chlorine),其中HOCl具有高度氧化性可穿透細胞壁,使細胞呼吸速率降低、細胞膜變異、細胞產生缺陷及中斷蛋白質合成,進而使細胞死亡,達到殺菌效果,為常用之消毒劑(Camper and Mcfeters, 1979)。
Cl2+ H2O
⇌ HOCl + H++ Cl- (式-1)
HOCl ⇌
H++ OCl- (式-2)
二、 水中餘氯
水中餘氯係指自來水消毒時,將氯氣投入水中後,與細菌、微生物、有機物、無機物等作用消耗一部分的氯以外,所殘餘的氯量,即稱為餘氯。餘氯可分為(1)自由有效餘氯— 以HOCl或OCl-存在的有效餘氯,殺菌力強,殺菌速度快,穩定性差,容易消耗,具有使用後不殘留之優點。(2)結合餘氯—當水中含有氨時,HOCl極易與氨發生反應(式3及式4)產生一氯胺(NH2Cl)、二氯胺(NHCl2) 及三氯胺(NCl3),上述除NCl3外,統稱為結合餘氯。雖然NH2Cl及NHCl2具殺菌力,但比HOCl弱,欲於同一時段獲得相同消毒效果所需之結合餘氯量將遠大於自由餘氯。
NH3+ HOCl →NH2Cl + H2O (一氯胺) (式-3)
NH2Cl + HOCl →NHCl2+ H2O (二氯胺) (式-4)
NHCl2+ HOCl →NCl3+ H2O (三氯胺) (式-5)
當NH3完全轉化成NCl3或被氧化成氮氣或其他氣體所需之加藥程度稱為”折點加氯” (圖1) (Break-point chloination),折點後自由餘氯出現,超過折點加氯之自來水消毒殺菌才可確保用水安全。一般而言,加氯量為水中氨氮之7.6倍,惟實際上需要8-10倍甚或更高倍數,係因需考量遠端輸送過程,隨著溫度及時間之增加,水中自由餘氯會有衰減情形發生,為了用水安全,自來水含自由有效餘氯是必要手段,台灣自來水水質標準規定自由有效餘氯濃度範圍為0.2-1.5 mg/L。
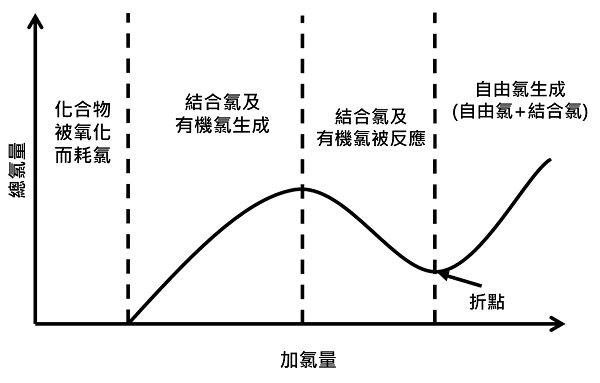
圖1折點加氯 (Wilsonet al.,2019)
三、 餘氯之疑慮
四、餘氯之移除
為了避免餘氯及其消毒副產物對人體產生危害,保險之作法為使用前將水中餘氯移除,可行之餘氯移除方法包括靜置、曝氣、吸附及電化學還原…等,各方法之原理詳述如下:
4-1 靜置
將自來水裝入容器中靜置於大氣環境2-3天,透過曝曬,氯氣將從水中揮發,達到除氯效果,惟靜置時間不宜超過三天,係因暴露於大氣環境時間過長,水中微生物會繁殖並影響水質。
4-2 曝氣
利用曝氣方式可稀釋水中氯氣並促進氯氣揮發至大氣中,此外,曝氣不僅可以去除餘氯,還能增加水中溶氧達到除鐵、錳之目的(式-6、式7、式8),亦可促進水中好氧微生物降解有機物。
2Mn2++ O2+2H2O = 2MnO2+4H+ (式-6)
4MnO2+ 3O2= 2Mn2O7 (式-7)
Mn2O7+6Fe2++ 15H2O = 2MnO2+ 6Fe(OH)3+12H+ (式-8)
4-3 活性碳吸附
活性碳屬於顆粒狀多孔性碳質吸附劑,廣泛應用於水質純化或家用除臭劑。一般活性碳表面基本上為疏水性,但含大量醛基(C=O)及羧基(COOH),產生具親水性及吸附有機物之氫鍵,活性碳內部有許多緻密孔洞,因此具有大比表面積,每公克活性碳含有超過1000 m2表面積,對有機物具優異移除能力。圖2為活性碳去除有機物之機制,水中分子量小於1000 Dalton之有機物容易進入活性碳微孔隙而被吸附,分子量大於1500 Dalton之有機物則無法自由進入,反而會造成細孔阻塞。因此,同一種活性碳無法吸附所有有機物,為提高有機物之吸附效率,先移除大分子有機物為重要因素。活性碳能有效將自由餘氯分解(式9至式14),純水系統藉此一性質移除自來水中之餘氯,亦可將活性碳放入水中,來達到去除餘氯之目的。
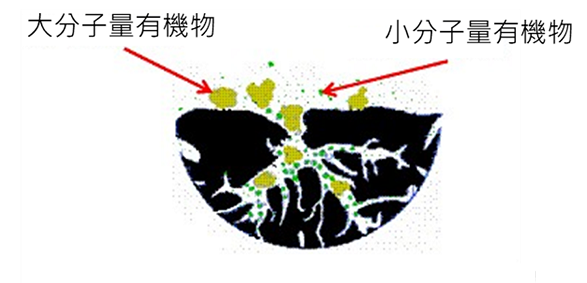
圖2活性碳吸附(廖世揚,2019)
游離氯去除
Cl2+ H2O + C →2H++ 2Cl-+ O + C (式-9)
C + O →CO (式-10)
CO + O →CO2 (式-11)
結合氯去除
NH2Cl + H2O + C →NH3+ H++ Cl-+ CO (式-12)
2NH2Cl + CO →N2+ H2O
+ 2H++ 2Cl-+ C (式-13)
3NH2Cl  N2 + NH3 + 3H+ + 3Cl- (式-14)
N2 + NH3 + 3H+ + 3Cl- (式-14)
4-4 電化學除氯
電化學除氯係利用外部電力或水流動能發電,供應電力至一組或多組電解池中,藉由電極設計與水力條件調控,水流經陽極與陰極之電解反應,將具強氧化力之自由餘氯(HOCl、OCl-)還原為惰性、不具氧化性之Cl-(圖3),達到除氯之目的。由電解還原技術之成功開發,工研院發展出全球首見之電化學除氯方法,此方法具有體積小、效率高、無耗材及使用簡單等優勢,技術實施具有多元特性,無副產物產出,亦無物質溶出之風險。
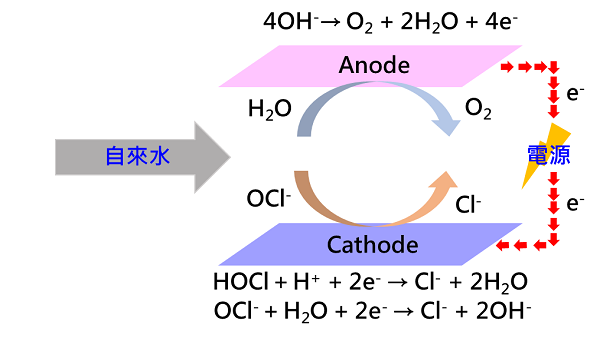
圖3 電化學除氯
五、結論
自來水消毒為用水安全必要之手段,自來水出廠時維持水中適當餘氯濃度,可確保自來水輸送及終端用戶之水質安全。由於考量餘氯長期暴露對人體健康影響,故於用水前移除餘氯逐漸受到用戶端所關注,目前市面已有一些除氯技術及產品(例如:除氯水龍頭、除氯濾心及除氯模組等)供民眾選擇。藉由加氯消毒以達儲水安全及使用前除氯以維持人體健康,可確保達成整體民生用水安全。
參考文獻
Camper, A. K, and G. A. Mcfeters,
“Chlorine injury and the enumeration of waterborne coliform bacteria,” Applied and Environmental Microbiology, Vol. 37, pp. 633-641 (1979).
Richardson,
S. D., “Disinfection by-products and other emerging contaminants in drinking
water,” Trends in Analytical Chemistry, Vol. 22, pp. 666-684 (2003).
Wilson,
R. E., I. Stoianov, and D. O’Hare, “Continuous chlorine detection in drinking
water and a review of new detection methods,” Johnson Matthey Technol, Vol. 63,
pp. 103-118 (2019).
廖世揚,「用再生活性碳吸附特性去除有機汙染物之研究」,碩士學位論文,國立中山大學環境工程研究所,高雄市 (2019)。
撰寫人:黃聖智
技術聯絡人:林冠佑
連絡電話:(03)5732640
E-Mail:gylin@itri.org.tw
- 文章投稿
- 親愛的讀者您好,若您想於本交流園地參與張貼、發表新文章,竭誠歡迎您來信與我們聯絡,謝謝!
- itriwater@itri.org.tw




